|
Les colorants bleus
Le
bleu coton = bleu de méthyle = bleu C4B
Ce colorant est le meilleur bleu d’aniline utilisable
en mycologie et lichénologie. Il est spécifique de la chitine, de la callose et du collagène. Il colore
principalement la chitine présente dans les parois des hyphes. Chez
de nombreux Ascomycètes il met également en évidence l’ornementation
sporale (qualifiée alors de cyanophile) souvent caractéristique des
espèces.
a) Le
bleu coton lactique
C'est l'un des colorants les plus utilisé en
lichénologie, l’acide lactique préserve les structures fongiques et
le bleu C4B colore les parois des hyphes (contenant de la chitine et
de la callose) mais aussi leur contenu (à un degré moindre toutefois
en fonction de la teneur en collagène) ; c'est aussi un colorant
indispensable pour révéler les ornementations sporales.
Parfois la coloration est lente, suite à la présence
d'acide lactique visqueux ; il suffit dans ce cas de chauffer très
légèrement la préparation afin de faciliter la pénétration du
colorant et la dissociation.
On le prépare en ajoutant tout simplement le bleu de méthyle
dans un peu d’acide lactique additionné de son volume d’eau.
Composition du bleu lactique :
Bleu de méthyle (= bleu
coton) .................. 0,1 g
Eau bidistillée ................................ .........
20 mL
Acide lactique (S.G. 1.21) ........................ 20 mL
Préparation : dissoudre 0,1 g de bleu de méthyle dans 20 mL
d'eau, ajouter les 20 g d'acide
lactique officinal (specific Gravity 1.21).
b) Le
bleu coton au lactophénol (= BCL) :
Si on désire garder la préparation ou prendre des
photographies, il est fortement recommandé d'utiliser le bleu coton
au lactophénol qui présente 3 avantages :
- un indice de réfraction supérieur (les contours
sont mieux définis) ;
- une viscosité plus importante qui limite fortement
l'évaporation du milieu de montage ;
- la présence de phénol qui permet de tuer les micro-organismes
éventuellement présents et provoque la désactivation de l’activité
lytique des enzymes cellulaires ce qui permet une conservation
beaucoup plus longue de la préparation.
Composition
du réactif :
Bleu de méthyle (= bleu coton C4B) ..... 0,1
g
Eau bidistillée ............................... ....... 20 mL
Acide lactique (S.G. 1.21) ..................... 20 g
Glycérol ...................................... ....... 40 g
Phénol ...................................... ......... 20 g
Préparation : dissoudre 0,1 g de bleu de méthyle dans 20 g d'acide
lactique officinal (specific Gravity 1.21) ajouter les 20 mL d'eau,
les 40 g de glycérol puis les 20 g de phénol (produit très toxique à
manipuler avec précautions sous la hotte reliée à l'extérieur).
Remarque 1 : parfois, la coloration est très lente à se développer (jusque 12
heures). Il est possible d’accélérer le processus en plaçant la
préparation quelques temps sur une plaque chauffante afin de rendre
la solution plus fluide (attention toutefois à ne pas porter à
ébullition afin d’éviter la déformation des cellules).
Remarque 2 : Après coloration au bleu coton lactophénolé, une teinte bleuâtre peut envelopper l’ensemble du
champ. Il suffit alors de monter la préparation colorée dans du
lactophénol. Seuls les éléments colorés restent nettement visibles,
elles se détachent mieux du fond qui n'est plus bleuâtre mais
parfaitement transparent, le contraste devient plus important ce qui facilite l’observation ou
la photomicrographie.
|
 |
|
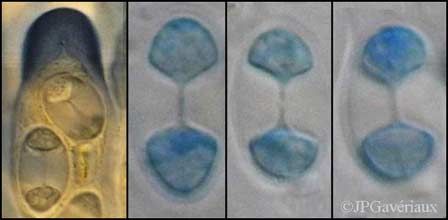
Spore de Caloplaca
ferruginea
(bleu coton C4B lactophénolé x1000) |
Remarque 3 : le matériel monté dans le Bleu coton au lactophénol
peut être conservé plusieurs mois en lutant la préparation. Il
suffit de déposer un peu de vernis à ongle tout autour de la lamelle
afin d’assurer l’isolement des structures et l’adhésion de la
lamelle sur la lame ; deux couches de vernis sont généralement
nécessaires (la deuxième après durcissement de la première).
Remarque 4 : ces colorants doivent être
utilisés avec précautions, éviter les contacts avec la peau, avec
les yeux, éviter de les respirer ; ce sont des substances toxiques
et irritantes qui ne doivent pas être utilisées par des enfants ou
des personnes non initiées à leur pratique.
|
![]()
![]()