|
L'utilisation du
microscope optique
en mycologie et lichénologie |
|||||||
Les produits chimiques indispensables
à la microscopie peuvent être obtenus une fois par an lors de la
session de microscopie qui se déroule chaque année, en février, au
laboratoire de Fontainebleau.
|
|||||||
| 5. Les deux colorants indispensables | |||||||
|
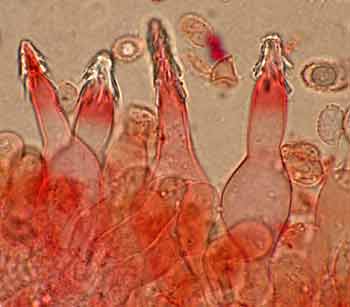
Un colorant est une substance chimique colorée capable de transmettre sa coloration à d’autres corps (le colorant transmet par diffusion ou diffraction les radiations complémentaires de celles qu’il absorbe). Les deux colorants à posséder obligatoirement sont le rouge Congo, le bleu coton. a) Le Rouge Congo est largement utilisé en microscopie mycologique comme colorant universel. Il colore en rose ± rougeâtre les parois des hyphes fongiques. Utilisable sur matériel frais et exsiccata, ce colorant montre bien les hyphes, les cloisons, les boucles et plus particulièrement la forme et la disposition des paraphyses. Sur matériel frais on utilise la solution aqueuse ; sur matériel sec, la solution ammoniacale (l’ammoniaque permet le ramollissement et le regonflement des cellules). En lichénologie on gagne beaucoup à le faire agir après action de la potasse. Composition du rouge Congo ammoniacal :
Préparation : Sous une hotte aspirante, dans un erlenmeyer à col étroit, mettre 1 g de rouge congo. Introduire rapidement 99 mL de la solution commerciale d’ammoniaque (à 30% généralement) et placer aussitôt un verre de montre sur l’erlenmeyer pour limiter l’évaporation de l’ammoniac qui est un gaz extrêmement irritant. Agiter avec l’agitateur magnétique et, éventuellement, chauffer pour faciliter la dissolution du colorant (sans excès car l’ammoniaque passe à l’état de gaz à partir de 35°C). Laisser refroidir puis filtrer en plaçant un couvercle sur l’entonnoir (d'après Erb et Matheis - Pilz Mikroskopie - 1983). Remarque 1 : Ne pas passer son nez au-dessus du flacon ! Remarque 2 : Ne laisser pas le flacon ouvert inutilement ! Cela évite l’odeur désagréable mais empêche aussi le contact avec le CO2 atmosphérique qui forme avec l’ammoniaque du carbonate d’ammonium responsable de la cristallisation du colorant ; la solution devient progressivement inefficace. Il est possible de prolonger son action en ajoutant un peu d’ammoniaque dans le flacon mais lorsque la concentration devient insuffisante, le Rouge Congo forme des dépôts et devient inutilisable au bout de 2 à 3 années. Composition du rouge Congo aqueux (seulement 0,5 % d’ammoniaque) :
Préparation : Sous la hotte aspirante reliée à l'extérieur, dissoudre les 3 g de Rouge Congo dans 98 mL d'eau bidistillée, ajouter ensuite 2 mL d’ammoniaque (d'après Erb et Matheis - Pilz Mikroskopie - 1983) afin de faciliter l’action du colorant. Remarque : une autre composition a été imaginée par M. Monod, qui ne met pas d’ammoniaque mais ajoute 1g de Sodium Dodécyl Sulfate (SDS), un agent tensio-actif anionique qui rend la solution plus mouillante. Le SDS ne doit toutefois pas être utilisé en présence de KOH (formation de précipités). Composition du rouge Congo SDS (Sodium Dodécyl Sulfate) :
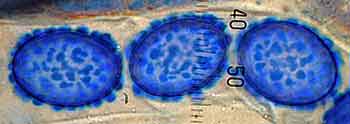
b) Le bleu coton au lactophénol (= BCL) : ce colorant est le meilleur bleu d’aniline utilisable en mycologie générale. Il est spécifique de la chitine, de la callose et du collagène. Il colore principalement la chitine présente dans les parois des hyphes. Chez de nombreux Ascomycètes il met également en évidence l’ornementation sporale (qualifiée alors de cyanophile) souvent caractéristique des espèces. L’acide lactique préserve les structures fongiques. L’apport de phénol permet de tuer les micro-organismes éventuellement présents, il y a ainsi désactivation de l’activité lytique des enzymes cellulaires ce qui permet une bonne conservation de la préparation. Composition du réactif :
Préparation : dissoudre 0,1 g de bleu de méthyle dans 20 g d'acide lactique officinal (specific Gravity 1.21) ajouter les 20 mL d'eau, les 40 g de glycérol puis les 20 g de phénol (produit très toxique à manipuler avec précautions sous la hotte reliée à l'extérieur). Parfois, la coloration est très lente à se développer (jusque 12 heures). Il est possible d’accélérer le processus en plaçant la préparation quelques temps sur une plaque chauffante afin de rendre la solution plus fluide (attention toutefois à ne pas porter à ébullition afin d’éviter la déformation des cellules).
Remarque 1 : Le matériel monté dans le Bleu coton au lactophénol peut être conservé en lutant la préparation. Il suffit de déposer un peu de vernis à ongle tout autour de la lamelle afin d’assurer l’isolement des structures et l’adhésion de la lamelle sur la lame ; deux couches de vernis sont généralement nécessaires (la 2ème après durcissement de la 1ère). Remarque 2 : Après coloration au bleu coton lactophénolé, une teinte bleuâtre peut envelopper l’ensemble du champ. Il suffit alors de monter la préparation colorée dans du lactophénol. Seuls les éléments colorés restent nettement visibles, le contraste devient plus important ce qui facilite l’observation ou la photomicrographie. Remarque 3 : Si on ne désire pas garder les préparations, il est inutile de mettre de la glycérine et du phénol. Il suffit alors de préparer du bleu lactique en ajoutant tout simplement le bleu de méthyle dans un peu d’acide lactique additionné de son volume d’eau. Composition du bleu lactique :
Ce milieu plus fluide pénètre plus facilement les éléments à colorer mais il possède toutefois un pouvoir regonflant très important et les dimensions des structures ne peuvent être mesurées précisément dans ce milieu de montage. |
|||||||