|
L'utilisation du
microscope optique
en mycologie et lichénologie |
|||||||
Les produits chimiques indispensables
à la microscopie peuvent être obtenus une fois par an lors de la
session de microscopie qui se déroule chaque année, en février, au
laboratoire de Fontainebleau.
|
|||||||
| 7. Les réactifs de Lugol et Melzer | |||||||
|
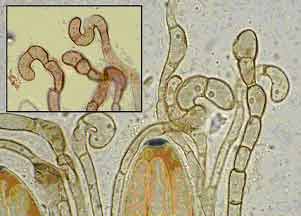
Un réactif microchimique est une substance qui donne une réaction chimique avec les tissus (ou faux tissus) en leur faisant prendre une coloration différente de leur couleur propre. a) Le Lugol ou eau iodée (notée I) est le réactif microscopique le plus utilisé pour l'étude des Ascomycètes et en lichénologie (les lichens étant, sauf exception, des ascolichens). Il est utilisé comme milieu de montage plus ou moins universel mais colore principalement, plus ou moins intensément, les structures apicales des asques et permet l’observation du tholus. Cette réaction colorée est connue depuis très longtemps et joue un rôle fondamental dans l’identification et la classification des familles, genres et espèces d'Ascomycètes lichénisés ou non. Ce réactif peu réfringent n’est pas éclaircissant mais donne des images à contours bien nets. Il colore en brun acajou le glycogène ; cette coloration tranche avec la teinte jaune brunâtre que prennent les parties non glycogéniques. Le lugol met également en évidence l’amyloïdité, l'hémiamyloïdité et la dextrinoïdité (voir caractéristiques ci-dessous). Composition du réactif :
Préparation : dissoudre dans 20 mL d'eau bidistillée, 1,5 g d'iodure de potassium (IK) puis 0,5 g d'iode (I) ; compléter avec de l’eau bidistillée jusqu’à 100 mL. Cette solution concentrée se conserve mal dans des petits en flacons (10 à 20 mL) et détruit plus ou moins rapidement les embouts en plastique des compte-gouttes qui doivent être changés régulièrement). Il est préférable de stocker le lugol en flacon de 100 mL. Si les flacons sont conservés en ambiance trop chaude (plus de 35°C pendant plusieurs semaines, il y a décoloration de la solution qui perd alors ses propriétés ; ce phénomène a été observé pendant la canicule prolongée de l'été 2003). Parfois la coloration est très forte et les détails ne sont pas visibles. Il faut recommencer la préparation en diluant quelques gouttes de lugol dans un verre de montre, dans une ou deux gouttes d’eau. Cette solution diluée ne se conserve pas longtemps. Autre technique possible recommandée par plusieurs auteurs : Faire agir successivement - KOH (dissociation partielle des cellules) - L’eau pour éliminer KOH – Le lugol (ou lugol dilué) - L’eau pour diminuer l’intensité de la coloration - Placer ensuite la lamelle, la potasse ayant partiellement désagrégé les tissus il suffit d’appuyer légèrement sur la lamelle pour dissocier les structures à observer. Remarque 1 : La coloration du tholus dépend de la concentration de la solution iodée mais également de l’intensité du prétraitement à la potasse ; l’expérience et l’intuition du préparateur jouent un rôle important dans le résultat final. L’étude des asques et du tholus est particulièrement utile pour identifier avec certitude des genres comme les Apicilia, Lecidea, Lecidella… très semblables par leurs autres caractères. Remarque 2 : Lorsque la coloration par le lugol ne semble pas suffisante, il est possible d'utiliser, en particuliers pour les structures apicales des asques, Le lugol double ou lugol concentré dans lequel la concentration en iode est deux fois plus importante. Composition du lugol double selon Baral :
Préparation : dissoudre dans 30 mL d'eau bidistillée, 3 g d'iodure de potassium (IK) puis 1 g d'iode (I) ; compléter avec de l’eau bidistillée jusqu’à 100 mL. Remarque 2 : Le lugol lactique se prépare de la même manière que le lugol normal mais l'eau est remplacée par de l'acide lactique. Il ne s'évapore pas aussi rapidement, présente un indice de réfraction plus élevé et donne dans certains cas des réactions plus fortes que le lugol normal. Composition du lugol lactique :
Préparation : dissoudre dans 20 mL d'acide lactique, 1,5 g d'iodure de potassium (IK) puis 0,5 g d'iode (I) ; compléter avec de l'acide lactique jusqu’à 100 mL.
b) Le réactif de Melzer est une solution proche du lugol mais contenant en plus du chloral hydraté qui est un éclaircissant et un regonflant (étude des exsiccata). Composition du réactif de Melzer (1924):
Préparation : dissoudre dans 20 ml d'eau bidistillée : 1,5 g d'iodure de potassium (IK) - 0,5 g d'iode - 20 g de chloral hydraté (d'après Erb et Matheis - Pilz Mikroskopie - 1983). C’est le réactif l'un des réactifs le plus utilisé en mycologie générale. Il met en évidence : - L’amyloïdité :
coloration bleu noirâtre de certains polymères glucidiques (qui se
trouvent dans les parois des hyphes ou dans les gels
extracellulaires). |
|||||||